Fuente: NUTRINIEWS
Fecha: Noviembre de 2022
Autores: Cândida Azevedo Zootecnista, MsC en Ciencia Animal y DsC en Ciencia Animal y Pasturas; Henry Cancian Zootecnista.
La estructura intestinal es crucial para la salud y el rendimiento de los animales. Además de las funciones digestivas del tracto gastrointestinal (TGI), las células inmunes y las estructuras linfoides presentes en el TGI constituyen el órgano inmune más grande del cuerpo. Las bases del sistema inmune asociadas a la mucosa intestinal se dividen en cinco esferas, que son:
Barrera epitelial, barrera física, capa celular epitelial (enterocitos y colonocitos), células caliciformes productoras de moco (células caliciformes), células de Paneth productoras de sustancias bactericidas (defensinas), células portadoras (células M), linfocitos T intraepiteliales (Figura 1);
![]() Folículos linfoides aislados, sitio de inicio de las respuestas inmunes adaptativas, estructura organizada de las poblaciones de células inmunes;
Folículos linfoides aislados, sitio de inicio de las respuestas inmunes adaptativas, estructura organizada de las poblaciones de células inmunes;
![]() Placas de Peyer, sitio de inicio de las respuestas inmunes adaptativas, estructura organizada de varios folículos linfoides con centros germinales;
Placas de Peyer, sitio de inicio de las respuestas inmunes adaptativas, estructura organizada de varios folículos linfoides con centros germinales;
![]() Tejido linfoide difuso, macrófagos, células dendríticas, mastocitos, linfocitos T irritantes, células T reguladoras, plasmocitos secretores de IgA dispersos en la propia lámina de la mucosa y;
Tejido linfoide difuso, macrófagos, células dendríticas, mastocitos, linfocitos T irritantes, células T reguladoras, plasmocitos secretores de IgA dispersos en la propia lámina de la mucosa y;
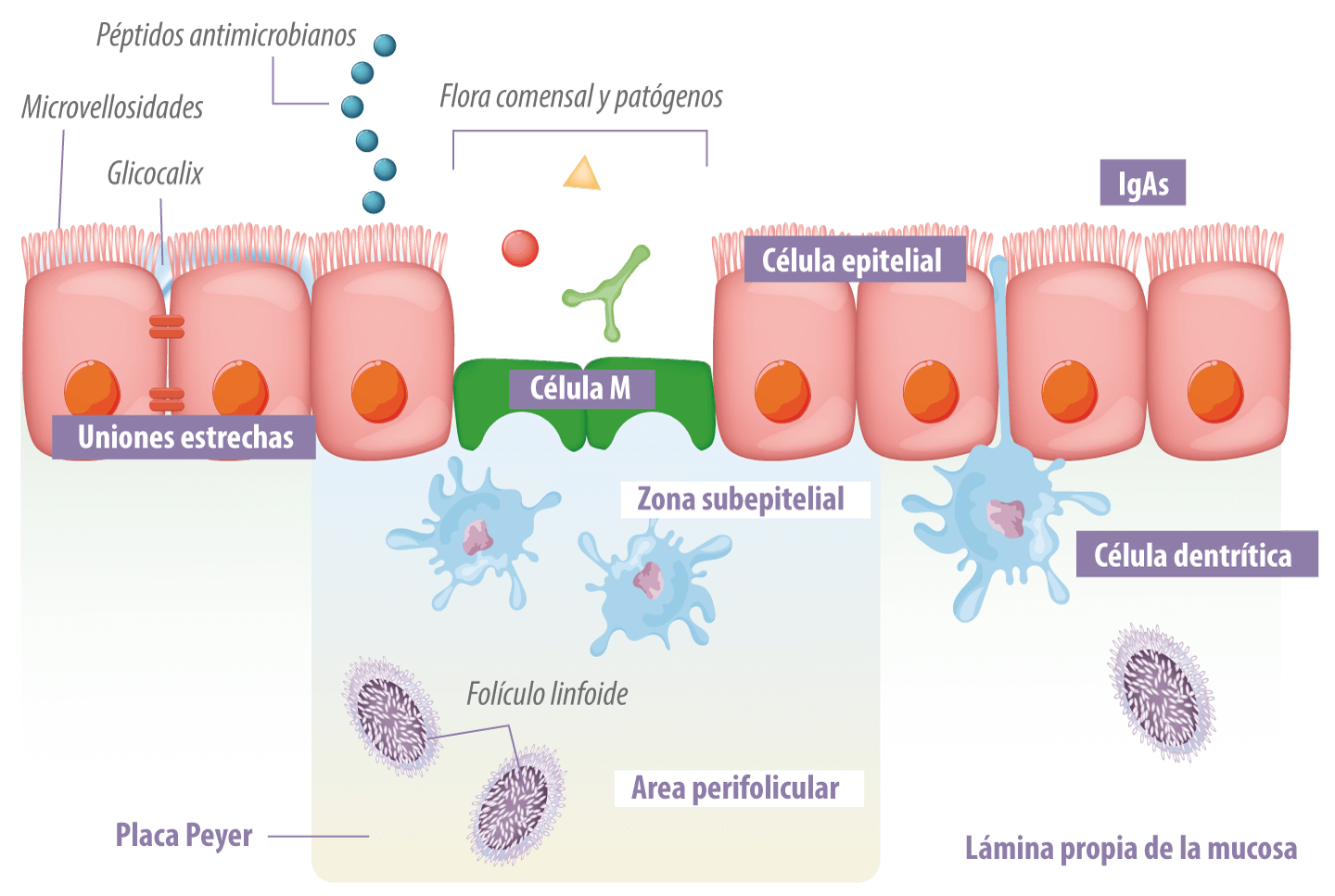 Figura 1. Estructura de defensa de la barrera epitelial intestinal (D. Artis. 2008; 8:411 Nature Reviews Immunology).
Figura 1. Estructura de defensa de la barrera epitelial intestinal (D. Artis. 2008; 8:411 Nature Reviews Immunology).
La superficie de la mucosa (Figura 2) está recubierta con un moco formado por mucinas, que son secretadas por las células caliciformes y crean una barrera que evita que las partículas más grandes, incluida la mayoría de las bacterias, entren en contacto directo con la capa de células epiteliales (Turner, 2009).
Las mucinas contienen diferentes oligosacáridos e incluyen glicoproteínas secretadas y de la superficie celular. Las mucinas secretadas, incluyendo MUC2, MUC5 y MUC6, forman un gel hidratado de 300 a 700 μm de espesor que tiene dos capas: una capa externa menos densa que normalmente está colonizada por bacterias y una capa interna densa que está unida al epitelio y está libre de bacterias.
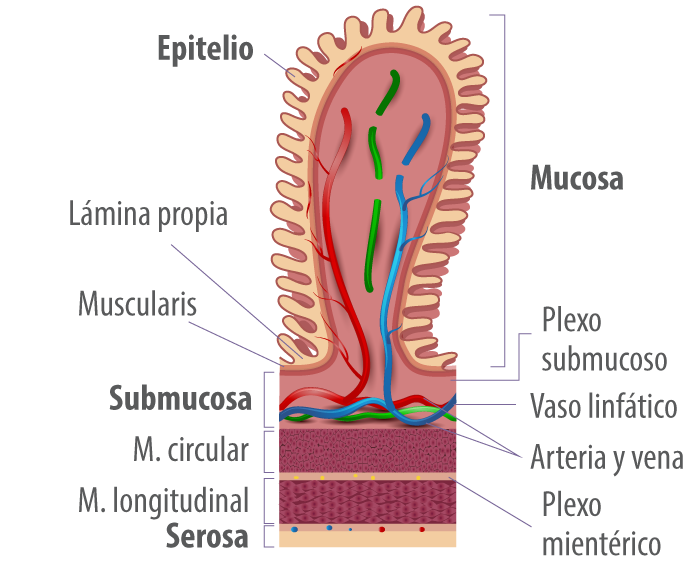 Figura 2. Representación del epitelio de la mucosa intestinal.
Figura 2. Representación del epitelio de la mucosa intestinal.
Las células de Paneth (Figura 3), ubicadas en las criptas del intestino delgado, secretan α-defensina. Mientras que en el colon, los tallos de β-defensina son producidos por células epiteliales absorbentes en criptas intestinales, algunas constitutivamente y otras en respuesta a la citoquina proinflamatoria IL-1 (Abbas et al., 2015).
La expresión de regeneración III γ (REGIIIγ) por las células epiteliales intestinales requiere señales de receptores similares a herramientas (TLRs) en respuesta a organismos compresivos, y su producción aumenta después de la colonización e infección por patógenos (Abbas et al., 2015).
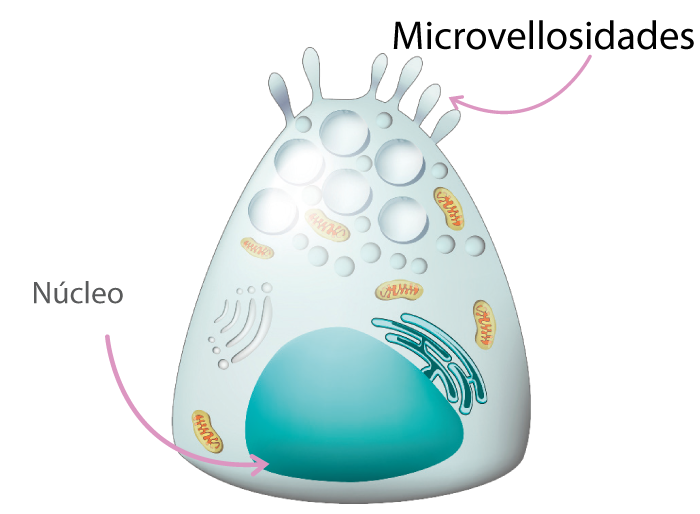 Figura 3. Célula de Paneth.
Figura 3. Célula de Paneth.
Respuesta inmune
La respuesta inmune innata comienza a partir de la mediación mediante el reconocimiento de patrones moleculares asociados a patógenos (PAMPs), así como receptores celulares de reconocimiento de patrones (PRRs). Los TLRs funcionan como PRRs en mamíferos y desempeñan un papel esencial en el reconocimiento de los componentes microbianos y la respuesta inmune innata.
Los TLRs se dividen en dos subgrupos, dependiendo de su ubicación celular y especificidad en relación con los PAMPs respectivos.
Un grupo consiste en TLR-1, TLR-2, TLR-4, TLR-5, TLR-6 y TLR-10 que se expresan en superficies celulares y reconocen componentes de membrana microbiana como lípidos, lipoproteínas y proteínas.
El otro grupo está compuesto por TLR-3, TLR-7, TLR-8 y TLR-9, que se expresan exclusivamente en la vesícula intracelular y reconocen el ADN microbiano (Cario, 2005).
La ruptura de la integridad de la barrera epitelial, caracterizada por una mayor permeabilidad intestinal, da lugar a la invasión de tejidos por bacterias patógenas (Figura 4), así como al aumento de antígenos dietéticos intactos en la mucosa intestinal que conducen a una mayor síntesis de citoquinas inflamatorias por las células del sistema inmune en la mucosa.
Esta reacción puede provocar una respuesta inmune lo que puede conducir a una respuesta inmune exacerbada y patológica, que culmina en un proceso de inflamación intestinal (Gonçalves et al., 2016).
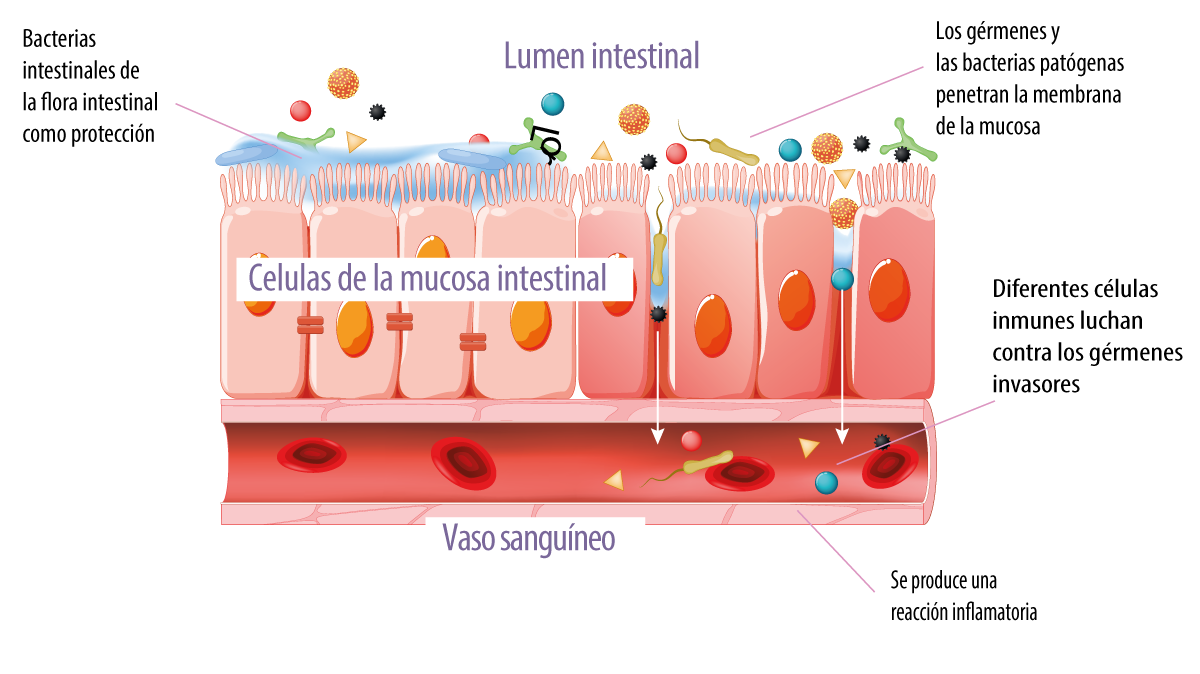 Figura 4. Reacción inmediata del sistema inmunitario ante la invasión de patógenos.
Figura 4. Reacción inmediata del sistema inmunitario ante la invasión de patógenos.
En estas condiciones, el organismo animal, para estar eficazmente protegido, debe poseer sistemas de defensa que detecten y eliminen los microorganismos invasores de forma eficaz, preferiblemente sin producir daños y molestias en los tejidos, función atribuida al sistema inmunitario adaptativo (Levinson, 2016).
Las respuestas inmunes adaptativas en el TGI se inician en conjuntos discretamente organizados de linfocitos y células presentadoras de antígeno estrechamente asociadas con el revestimiento de la mucosa epitelial del intestino, así como en los ganglios linfáticos mesentéricos (Abbas et al., 2015).
![]() Los tejidos linfoides organizados y no encapsulados que consisten en células del sistema inmunitario se encuentran asociados con las superficies mucosas (Figura 5) de los tractos respiratorio, gastrointestinal y urogenital, y se denominan colectivamente MALT (por sus siglas en inglés: Mucosa-associated lymphoid tissue; el tejido linfoide asociado a la mucosa).
Los tejidos linfoides organizados y no encapsulados que consisten en células del sistema inmunitario se encuentran asociados con las superficies mucosas (Figura 5) de los tractos respiratorio, gastrointestinal y urogenital, y se denominan colectivamente MALT (por sus siglas en inglés: Mucosa-associated lymphoid tissue; el tejido linfoide asociado a la mucosa).
![]() Específicamente en la mucosa del TGI se encuentra el sistema GALT (por sus siglas en inglés: gut-associated lymphoid tissue), el tejido linfoide asociado al intestino, que consiste en tejido linfoide denso (Gonçalves et al., 2016).
Específicamente en la mucosa del TGI se encuentra el sistema GALT (por sus siglas en inglés: gut-associated lymphoid tissue), el tejido linfoide asociado al intestino, que consiste en tejido linfoide denso (Gonçalves et al., 2016).
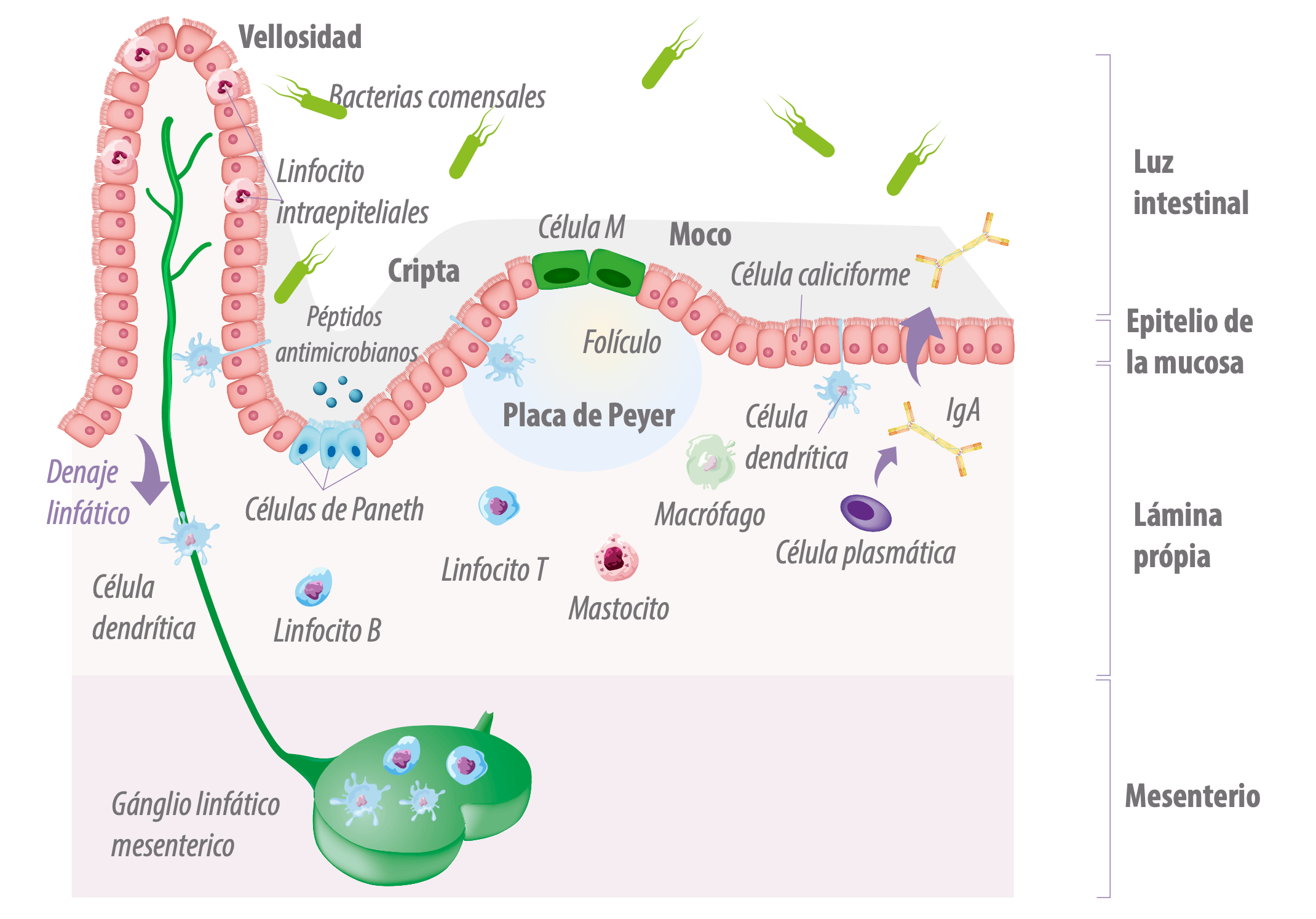 Figura 5. Organización de los tejidos linfoides en la superficie del tracto intestinal.
Figura 5. Organización de los tejidos linfoides en la superficie del tracto intestinal.
En GALT, el tejido linfoide se distribuye a lo largo de estructuras tales como:
![]() Ganglios linfáticos mesentéricos (LN),
Ganglios linfáticos mesentéricos (LN),
![]() La lámina propia (LP) como las placas de Peyer (PP) en el íleon, o como agregados linfoides más difusos (Vega- Lopez et al., 2012).
La lámina propia (LP) como las placas de Peyer (PP) en el íleon, o como agregados linfoides más difusos (Vega- Lopez et al., 2012).
Además de estas estructuras, las células presentadoras de antígeno (APCs), las células dendríticas (DCs) y los macrófagos, las células T y las áreas de células B, con centros germinales en LP, y las células natural killer (NK) forman la estructura GALT (Cunha, 2013).
Las estructuras GALT más prominentes son las placas de Peyer, que se encuentran principalmente en el íleon distal, y en pequeños agregados de folículos linfoides o folículos aislados en el apéndice y el colon.
Las placas de Peyer tienen la estructura de folículos linfoides, con centros germinales que contienen linfocitos B, células T auxiliares foliculares, células dendríticas foliculares y macrófagos. Los centros germinales en los folículos están rodeados por células B foliculares inmaduras que expresan IgM e IgD. Una región llamada cúpula ubicada entre los folículos y el epitelio de revestimiento contiene linfocitos B y T, células detríticas y macrófagos (Abbas et al., 2015).
La principal vía de distribución de antígenos en el lumen para GALT ocurre a través de células especializadas, células microfold (M), que se encuentran en regiones del epitelio intestinal llamadas epitelio de cúpula o asociadas con el folículo (FAE) (Abbas et al., 2015).
Aunque las células M juegan un papel primordial en la respuesta inmune frente a microorganismos luminales, algunos microorganismos patógenos han evolucionado para engañar el mecanismo de acción de las células M, utilizándolas como vía de invasión a través de la barrera mucosa.
El mejor ejemplo descrito es la Salmonella typhimurium, similar al patógeno humano S. typhi, que causa la fiebre tifoidea. Las células M expresan lectinas que permiten la unión específica y la internalización de estas bacterias.
Las bacterias son citotóxicas para las células M, lo que lleva a una mayor permeabilidad intestinal (Figura 6) y, posteriormente, a la proliferación de microorganismos (Abbas et al., 2015).
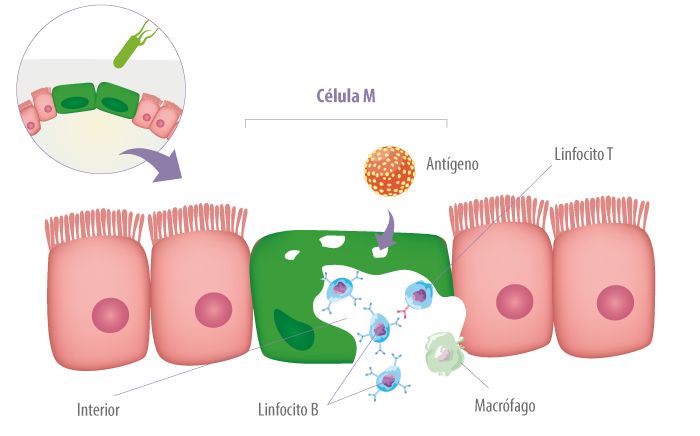
Figura 6. Algunos patógenos utilizan las células M como vía de invasión a través de la mucosa. Posteriormente, otras células de defensa entran en acción.
Las células dendríticas y los macrófagos son células centinela y procesadores de antígenos, como resultado, el procesamiento antigénico puede iniciarse simultáneamente a la eliminación del invasor por defensas innatas.
Después de la fagocitosis, los microorganismos invasores se procesarán intracelularmente y se fragmentarán en péptidos más pequeños, que se acoplarán a los receptores especializados de presentación de antígenos, llamados moléculas del complejo principal de histocompatibilidad (MHC),
y luego se transportarán a la superficie celular, de modo que el desencadenamiento de la inmunidad adaptativa ocurra cuando se reconozcan estos péptidos vinculados al MHC por receptores específicos de los linfocitos (Tizard, 2008).
También hay linfocitos T y B efectores (linfocitos T CD4 auxiliares, linfocitos T CD8 citotóxicos y plasmocitos secretores de IgA) previamente activados/diferenciados en los GALT o ganglios linfáticos de drenaje (Gonçalves et al., 2016).
Estos linfocitos son heterogéneos, principalmente (80%) fenotipo CD8, con abundantes gránulos citoplasmáticos que contienen moléculas citotóxicas, capacidad para producir varias citoquinas (como IFN-γ, IL-2, IL-4 o IL-17) y pueden dividirse en poblaciones celulares que expresan en la superficie el receptor de antígeno (TCR/T cell receptor) constituido por cadenas αβ o γδ (Gonçalves et al., 2016).
Los linfocitos T intraepiteliales dominantes corresponden a CD8αβ+/TCRαβ+, que penetra en el epitelio intestinal aumentando la expresión de integrinas específicas y receptores de quimiocinas después de su activación en órganos linfoides secundarios (Gonçalves et al., 2016).
Los linfocitos T intraepiteliales naturales TCRγδ+ tienen funciones primordiales en la mucosa intestinal, incluyendo:
![]() Mantenimiento de la función de barrera epitelial (control del crecimiento de células epiteliales, secreción de TGF-β),
Mantenimiento de la función de barrera epitelial (control del crecimiento de células epiteliales, secreción de TGF-β),
![]() Homeostasis tisular y,
Homeostasis tisular y,
![]() Protección contra patógenos intestinales (producción de citoquinas inflamatorias, citotoxicidad) (Gonçalves et al., 2016).
Protección contra patógenos intestinales (producción de citoquinas inflamatorias, citotoxicidad) (Gonçalves et al., 2016).
Los linfocitos T son esencialmente CD4+ o CD8+ (ambos TCRαβ+), exhiben un fenotipo de memoria (CD45RD) y están asociados con la mucosa intestinal por la expresión de integrinas específicas (α4β7) y receptores de quimiocinas (CCR9) que dirigen estos linfocitos después de su activación y diferenciación en células efectoras (Gonçalves et al., 2016).
Luego, los linfocitos T efectores salen del tejido linfoide a través de los vasos linfáticos eferentes, caen en la circulación sanguínea sistémica y regresan nuevamente al intestino, donde ayudarán en la eliminación de un determinado antígeno (Gonçalves et al., 2016), desencadenando la respuesta inmune, que a su vez ya está amplificada y tiene una población más diversa de células presentadoras de antígenos, tales como:
![]() Macrófagos,
Macrófagos,
![]() Linfocitos B,
Linfocitos B,
![]() Además de las células dendríticas.
Además de las células dendríticas.
En este nuevo contacto con el antígeno (promovido por las células presentadoras de antígenos), los linfocitos T efectores responden más rápido y vigorosamente, secretando citoquinas como IFN-γ, IL-17, TNF-α, linfotoxina-α o IL-2, dependiendo del perfil de la célula T efectora (Th1 o Th17). Cada citoquina tiene una función específica en la coordinación de la respuesta inmune desencadenada.
El IFN-γ estimula las células presentadoras de antígenos para producir IL-12 y específicamente en macrófagos activa la producción de otras citoquinas inflamatorias como IL-1, IL-6, IL-8 IL-18 y TNF-α, así como especies reactivas de oxígeno y nitrógeno (Gonçalves et al., 2016).
La IL-2 estimula el crecimiento y la proliferación de linfocitos T y células B, además de inducir la producción de otras citoquinas, como por ejemplo, IFN-γ y TNF-β, lo que resulta en la activación de monocitos, neutrófilos y células natural killer (Oliveira et al., 2011).
Estas células se activan en los ganglios linfáticos mesentéricos, en los folículos linfoides aislados de la mucosa intestinal y también en las placas de Peyer, con citoquina TGF-β y se diferencian en células productoras de anticuerpos del isotipo IgA en su forma dimérica, IgA secretoria (sIgA) o polimérica.
La IgA desempeña un papel importante en la protección del epitelio de la mucosa contra patógenos invasores, modulando la composición de la microbiota intestinal y manteniendo la homeostasis contra los antígenos comensales y los antígenos alimentarios (Gonçalves et al., 2016).
Las sIgAs se unen a las bacterias comensales en la luz intestinal y permiten su transporte a la mucosa desde la unión del complejo sIgA/ antígeno a receptores específicos expresados en las células M intestinales.
En vista de lo anterior, es evidente que el intestino, además de ser un órgano responsable de los procesos de digestión y absorción de nutrientes, desempeña un papel primordial en la defensa y respuesta inmune del cuerpo. Así, el mantenimiento de la salud intestinal se reflejará en la salud y el rendimiento productivo de los animales.

